Кандыдат біялагічных навук дацэнт кафедры генетыкі біялагічнага факультэта БДУ Васіль ГРЫНЁЎ апублікаваў больш за 140 навуковых прац і на дадзены момант з’яўляецца адным з самых рэйтынгавых супрацоўнікаў факультэта.
 На рахунку Васіля Віктаравіча звыш 20 актаў укаранення вынікаў выканання НДР у навучальны працэс і навуковую практыку, патэнт і мноства навукова-даследчых праектаў, якія ўваходзілі ў праграмы БРФФД (Беларускі рэспубліканскі фонд фундаментальных даследаванняў), ДКПНД (Дзяржаўная комплексная праграма навуковых даследаванняў), ДПНД (дзяржаўная праграма навуковых даследаванняў) і ІНТАС (ІНТАС – Міжнародная асацыяцыя па развіцці супрацоўніцтва з навукоўцамі з новых незалежных дзяржаў былога СССР). Цяпер навуковец засяроджаны на напісанні доктарскай дысертацыі «Заканамернасці сплайсінгу малекул РНК генаў чалавека, актыўных у клетках гемапаэтычнага паходжання».
На рахунку Васіля Віктаравіча звыш 20 актаў укаранення вынікаў выканання НДР у навучальны працэс і навуковую практыку, патэнт і мноства навукова-даследчых праектаў, якія ўваходзілі ў праграмы БРФФД (Беларускі рэспубліканскі фонд фундаментальных даследаванняў), ДКПНД (Дзяржаўная комплексная праграма навуковых даследаванняў), ДПНД (дзяржаўная праграма навуковых даследаванняў) і ІНТАС (ІНТАС – Міжнародная асацыяцыя па развіцці супрацоўніцтва з навукоўцамі з новых незалежных дзяржаў былога СССР). Цяпер навуковец засяроджаны на напісанні доктарскай дысертацыі «Заканамернасці сплайсінгу малекул РНК генаў чалавека, актыўных у клетках гемапаэтычнага паходжання».
– Распавядзіце, калі ласка, пра Вашу доктарскую дысертацыю.
– Уявіце сабе вялікую тоўстую кнігу старонак на 500. Калі паспрабаваць запісаць у такой кнізе ўсю генетычную інфармацыю, якая захоўваецца ў нашым геноме, то мы атрымаем амаль 4,5 тыс. тамоў суцэльнага тэксту. Гэта шмат, ці не так? І чытаецца гэты тэкст адмысловым чынам. Звычайны твор мы чытаем слова за словам, сказ за сказам, абзац за абзацам. А генетычная інфармацыя, якая захоўваецца ў нашых клетках, чытаецца па-іншаму. Першапачаткова яна счытваецца вялікімі кавалкамі, пасля чаго гэтыя кавалкі рэжуцца і склейваюцца ў іншай паслядоўнасці. Вяртаючыся да аналогіі з кнігай, калі б чытанне такой кнігі ішло ў клетцы, то яна ўвесь час перараблялася б так, што розныя чытачы вынеслі б з яе зусім розныя рэчы. У клетцы пры чытанні інфармацыя ўвесь час фрагментуецца і сшываецца ў новыя часткі, раздзелы і тамы. Вось я якраз і зацікавіўся тым, як адбываецца гэта чытанне і ўтварэнне канчатковых варыянтаў генетычнага тэксту, якія мы і называем малекуламі спелых РНК. А той працэс, які з частак састыкоўвае новы канчатковы тэкст, мы называем сплайсінгам.
Сплайсінг быў адкрыты Філам Шарпам яшчэ ў 1980-х гадах, за што ён атрымаў Нобелеўскую прэмію. Гэта складаны працэс, які кіруецца ў клетцы шматкампанентнымі малекулярнымі машынамі. І мы не да канца разумеем правілы, па якіх працуюць такія малекулярныя машыны, як выбіраюцца кавалкі інфармацыі, якія захоўваюцца, якія выдаляюцца, як аб’ядноўваюцца ў канчатковы тэкст тыя, якія захоўваюцца. Высвятленне гэтых правіл – адзін з маіх навуковых інтарэсаў. Пры гэтым мы засяродзіліся не на любых клетках чалавека, а на лейкозных (ракавых) і нармальных клетках крыві. Мой асобны інтарэс – высветліць, як уплываюць на чытанне генетычнай інфармацыі і сплайсінг гены лейкозагенезу. Да такіх генаў адносяць, як правіла, мутантавыя гены, адказныя за ўзнікненне і развіццё лейкозу ў чалавека.
– Чаму Вы абралі менавіта гэты напрамак у сваім даследаванні?
– Таму што, як вывысвятляецца, для нашага арганізма найважнейшым з’яўляецца не столькі тое, якая там генетычная інфармацыя маецца, колькі тое, як яна счытваецца і рэалізуецца. Бывае, што ген і пашкоджаны мутацыяй, але ўключаюцца механізмы, у тым ліку звязаныя са сплайсінгам, якія кампенсуюць паломку. Да разумення важнасці працэсаў, звязаных з рэалізацыяй генетычнай інфармацыі, я прыйшоў, вядома, паступова. Можна лічыць, што я пачаў займацца гэтай працай яшчэ ў студэнцкія гады. Так атрымалася, што ўжо на другім курсе я шукаў навуковую лабараторыю, у якую можна было б патрапіць студэнту біялагічнага факультэта і рабіць курсавыя, а потым і дыпломную працу. У канчатковым выніку я патрапіў у Інстытут гематалогіі і пералівання крыві, цяпер гэта Рэспубліканскі навукова-практычны цэнтр трансфузіялогіі і медыцынскіх біятэхналогій.
Доктар медыцынскіх навук прафесар Міхаіл Пятровіч Патапнёў быў кіраўніком не толькі лабараторыі, але і аддзела, дзе займаліся вывучэннем супрацьпухліннага імунітэту. Ён прапанаваў мне засяродзіцца на гэтай сферы. У выніку мае дыпломная праца і кандыдацкая дысертацыя былі звязаны з вывучэннем узаемадзеянняў паміж лейкознымі клеткамі і нармальнымі клеткамі імуннай сістэмы (якія паходзяць, дарэчы, таксама з клетак крыві). І потым, ужо пасля абароны кандыдацкай дысертацыі, я працягнуў працу, якую вёў да гэтага, але дапоўніў яе малекулярна-генетычнымі даследаваннямі механізмаў рэалізацыі генетычнай інфармацыі ў лейкозных і нармальных клетках крыві.
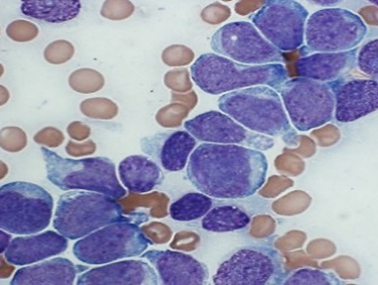
На малюнку – лейкозныя і нармальныя клеткі крыві чалавека
– Што самае цікавае ў Вашай працы?
– Цікавае ўсё, але ёсць прыярытэтныя ідэі. Цяпер адной з такіх ідэй, над якой я і мае калегі актыўна працуем, з’яўляецца пошук у лейкозных клетках малекулярных структур, якія былі б прывабныя для клетак імуннай сістэмы, каб яны маглі эфектыўна распазнаваць ракавыя клеткі і знішчаць іх.
Справа ў тым, што ў наш час для лячэння лейкозаў, а таксама іншых формаў раку ўсё больш інтэнсіўна выкарыстоўваюць так званую CAR-тэрапію. Яна спалучае ў сабе магчымасці клетачнай і малекулярнай біялогіі, а таксама генетычнай інжынерыі. Для гэтага генна-інжынерным шляхам змяняюць адмысловую групу клетак крыві, якія называюцца Т-лімфацытамі, так, каб яны сталі агрэсіўнымі супраць лейкозных клетак. Іх змяшчаюць у арганізм чалавека, і гэтыя клеткі даволі эфектыўна знаходзяць і знішчаюць лейкозныя.
Але для таго, каб яны іх знайшлі, трэба ведаць, чым лейкозныя клеткі адрозніваюцца ад нармальных. Тут ёсць пэўныя праблемы. Лейкозныя клеткі, як і іншыя ракавыя, на працягу свайго развіцця імкнуцца паводзіць сябе даволі ціха ў дачыненні да імуннай сістэмы, не раздражняць яе. У іх фактычна няма нічога, што імунная сістэма распазнавала б як асабліва чужароднае, а нават калі такія структуры ў ракавых клетак і з’яўляюцца ў пачатку зараджэння, то яны хутка змяняюцца і эвалюцыянуюць, каб пазбавіцца ад такіх структур. Так што сама па сабе ідэя выкарыстання генетычна змененых Т-лімфацытаў добрая, але трэба адшукаць «ахілесаву пяту» лейкозных клетак – штосьці, што будзе адрозніваць іх з імуналагічнага пункту гледжання ад нармальных клетак крыві. І адна з нашых ідэй заключаецца ў тым, што мы можам знайсці гэтыя слабыя месцы лейкозных клетак, вывучаючы сплайсінг, чым мы і займаемся ў наш час.
– Вы працавалі ў розных краінах, якая са стажыровак паўплывала на Вас больш за ўсё?
– Так, я стажыраваўся і працаваў у Германіі, Люксембургу, Нарвегіі, Вялікабрытаніі і Аўстрыі. У некаторыя краіны, напрыклад, у Францыю, я хутчэй зазіраў у якасці госця.
Першая мая паездка ў Германію, яшчэ ў двухтысячных, уразіла мяне больш за ўсё. Гэта была праграма ІНТАС, па якой вылучаліся гранты для навукоўцаў з былога Савецкага Саюза, каб яны маглі займацца даследаваннямі і ў сябе на радзіме, і некаторы час працаваць у еўрапейскіх лабараторыях.
У той час арганізацыя навукова-даследчай працы ў нас і ў Германіі істотна адрознівалася. Там, калі мне былі патрэбныя нейкія рэагенты, то ўжо праз дзень-два яны былі ў мяне на стале, а ў нас даводзілася чакаць месяцамі, што, натуральна, вельмі моцна адбівалася на эфектыўнасці рашэння задач. Бо ў фундаментальнай навуцы кожны новы крок – гэта крок у цемру: ты знаходзішся ў коле, асветленым наяўнымі ведамі, а што там, за мяжой святла і цемры, ты можаш толькі меркаваць і ніхто не можа ацаніць правільнасць тваёй здагадкі. Таму ў навуцы ніхто не гарантуе поспех наступнага кроку. Заўсёды ёсць рызыка спатыкнуцца і патрапіць у балота, а каб выбрацца з яго і знайсці наступную, больш надзейную, сцяжынку, трэба час. І чым хутчэй я магу выправіць памылку (напрыклад, хутка атрымаць новыя рэагенты для новага эксперыменту), тым хутчэй я прайду гэты шлях. А гэта можна рабіць, калі добра развітая інфраструктура, якая абслугоўвае навуковую сферу. У Германіі мноства кампаній, якія вырабляюць тыя самыя рэагенты. Там развітая лагістыка, няма бюракратызацыі працэсу атрымання матэрыялаў. Гэта адбывалася проста: пішаш на паперы спіс, аддаеш матэрыяльна адказнаму, і далей гэта не твае клопаты. На наступны дзень яны будуць ляжаць у скрынцы на стала, што, вядома, вельмі здзіўляла.
Яшчэ здзіўляла пастаянная камунікацыя, пастаянныя «лабмітынгі», калі ўся лабараторыя сустракаецца і абмяркоўвае бягучыя вынікі, што атрымалася, а што не, які наступны будзе крок. Гэта праходзіла мінімум раз у тыдзень, і калі ўсе сустракаліся, то ці па чарзе распавядалі, што паспелі зрабіць за тыдзень, ці прадстаўлялі больш грунтоўныя даклады за нейкі прамежак часу. Былі таксама рэгулярныя інстытуцкія сустрэчы, калі, напрыклад, раз у месяц увесь інстытут збіраўся, і хтосьці адзін рабіў вялікі даклад пра працу, праробленую за паўгода. Шмат запрошаных навукоўцаў, лектараў, якія прыязджалі з іншых краін. Яны праводзілі нейкія спецыялізаваныя семінары і г. д. Часам гэта нават стамляла, таму што толькі сышоў з аднаго лабмітынгу ці лекцыі, як шэф адразу кліча на наступны. І я, бывала, спецыяльна прапускаў такія мерапрыемствы, таму што хацелася папрацаваць самому, атрымаць свае ўласныя вынікі. Абмен інфармацыяй заўсёды ішоў вельмі інтэнсіўна. І калі я вярнуўся сюды, то са сваімі студэнтамі, магістрантамі і аспірантамі арганізоўваў штосьці падобнае. У БДУ мая асноўная праца – выкладчыцкая, і яна забірае шмат часу. Тым не менш я ўсё-такі камунікацыю наладзіў і нават спрабаваў распаўсюдзіць на кафедры, але мае калегі гэта ўспрынялі без асаблівага энтузіязму. Хоць падобныя сустрэчы робяцца, каб як мага раней выявіць сваю памылку і прыдумаць, як яе выправіць. Больш за тое, можа, хтосьці з прысутных ужо сутыкаўся з такой памылкай і ўжо ведае, чым дапамагчы, і падзеліцца досведам.
У Англіі я працаваў некалькі разоў. Апошні раз мяне туды запрасілі як прафесара па біяінфарматыцы. Але не лекцыі чытаць, а вырашаць задачы, звязаныя з аналізам вялікіх медыка-біялагічных даных.
З Нарвегіяй у нас быў праект хутчэй адукацыйнага плана, у якім я быў як шараговы ўдзельнік. Трэба было распрацаваць сумесную навучальную праграму па міждысцыплінарнай падрыхтоўцы магістрантаў і аспірантаў для працы з вялікімі біялагічнымі і медыцынскімі данымі. Прычым праект прадугледжваў распрацоўку камбінаванай праграмы, дзе быў бы і аўдыторны, і анлайн-кампанент. У рамках гэтага праекта я нават ездзіў у Нарвегію запісваць відэалекцыі ў Green Studio Нарвежскага ўніверсітэта прыродазнаўчых навук. Тады гэта быў мой першы падобны досвед, і я зразумеў, што гэта не так проста.
У 2018 годзе ў рамках праекта PRINTEL у мяне была невялікая стажыроўка ў Аўстрыі ў горадзе Грац, якая праходзіла ў Інстытуце міжнароднага менеджменту Універсітэта прыкладных навук Ёанеум і была накіравана на вывучэнне метадаў гібрыднага навучання. Гэта навучанне студэнтаў не толькі аўдыторна, але і на разнастайных платформах тыпу Moodle. Цяпер, пасля кавіду, у нас гэта распаўсюджана, але калі я праходзіў стажыроўку, то падобныя фарматы толькі пачыналі выкарыстоўваць. Потым я праводзіў у нас у БДУ цыкл семінараў для супрацоўнікаў і выкладчыкаў, як можна арганізаваць і праводзіць такое навучанне.
– Вы падтрымліваеце сувязь з замежнымі калегамі?
– Цяпер афіцыйных праектаў у мяне з імі няма, але камунікацыя захоўваецца. Адзін з навукоўцаў, з якімі я даўно знаймы, прафесар Олаф Хайдэнрайх, працуе ў Нідэрландах кіраўніком лабараторыі ў Дзіцячым анкалагічным медыцынскім цэнтры імя прынцэсы Максімы ва Утрэхце. Гэта адзін з найбуйнейшых у свеце навуковых цэнтраў такога роду. І зусім нядаўна ў нас выйшаў сумесны артыкул у часопісе Blood, прысвечаны таму, як пры развіцці лейкозаў адбываецца пераход з адной формы хваробы ў іншую. Часопіс выдаецца Амерыканскім грамадствам гематолагаў, і ў галіне гематалогіі (навукі, якая вывучае кроў) ён з’яўляецца самым прэстыжным. Гэта яшчэ і мой улюбёны часопіс. У студэнцкія і аспіранцкія гады, калі я пачаў займацца навуковай працай, прафесар Патапнёў параіў мне звярнуць увагу на гэта выданне, што я і зрабіў, і заахвоціўся да чытання публікаваных там артыкулаў.
У мяне і раней было некалькі невялікіх публікацый у гэтым часопісе, але такая маштабная ўпершыню. Гэты артыкул выдатна ілюструе, наколькі складанымі сталі задачы сучаснай навукі. Іх часцяком немагчыма вырашыць не тое што ў адзіночку, але нават цэлымі групамі, лабараторыямі і інстытутамі. У такіх выпадках збіраюцца кансорцыумы з розных інстытутаў і розных краін, каб падзяліць складаную задачу на падзадачы і размеркаваць іх паміж тымі, хто профі ў той ці іншай сферы. Канкрэтна ў згаданым артыкуле ў суаўтарстве было 57 чалавек з 7 краін і 20 інстытутаў. Вырашалася гэта задача 10 гадоў, і яе рашэнне дае шанцы, што рэцыдывы лейкозаў (аднаўленне хваробы пасля, здавалася б, паспяховага пярвічнага лячэння) стануць лячыцца эфектыўней.
– Па сваёй сутнасці Вы больш даследчык ці выкладчык?
– Як па мне, навука для выкладчыка БДУ павінна ўсё ж такі стаяць на першым месцы. Ён павінен быць у першую чаргу навукоўцам, які атрымлівае новыя веды і павінен абавязкова гэтыя веды распаўсюджваць. Для распаўсюджання ёсць шмат спосабаў: часопісныя публікацыі, кнігі, выкладанне, удзел у навуковых канферэнцыях… Таму я выпрацаваў для сябе такое стаўленне да працы, што я ў першую чаргу навуковец, які атрымлівае новыя веды, інтэгруе іх ва ўжо існую сістэму навуковых ведаў, а потым імкнецца перадаць гэтыя веды іншым людзям, асабліва студэнтам.
У планах на наступны год у Васіля Віктаравіча завяршэнне працы над манаграфіяй, падрыхтоўка рукапісу доктарскай дысертацыі і некалькіх навуковых артыкулаў да публікацыі. Пасля абароны навуковец хацеў бы напісаць серыю кніг, каб абагульніць назапашаныя веды і досвед, а таксама падрыхтаваць шэраг навучальных выданняў для студэнтаў і магістрантаў па новых дысцыплінах у галіне біяінжынерыі і біяінфарматыкі, якія з гэтага года пачалі выкладацца на біялагічным факультэце.
Ганна КАЗАКОВА





